pH ピーエイチ 水素イオン指数 power of Hydrogen
pH ピーエイチ 水素イオン指数 power of Hydrogen
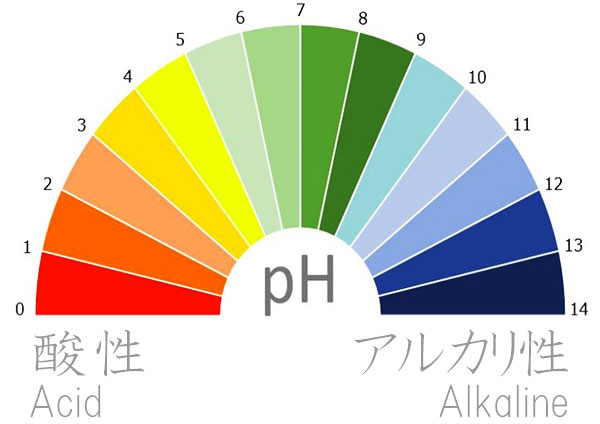
pH(ぴーえいち)のまとめです。pHはpower of Hydrogenの略で、水素イオン指数のことです。わかりやすくいえば、どれだけ水素イオンが溶けているか、数値によって表すのがpHです。
pHの数値は0--14までありpH7が中性、pHが7より小さくなるほど酸性が強く、pHが7より大きくなるほどアルカリ性が強くなります。
【化学教材】
化学の重要用語句のまとめ解説教材です。公立高校・中高一貫校・大学受験生のためにプロ家庭教師がカリキュラム設計しています。
無料の解説・問題・解答のダウンロードがあるので、初心者でも独学で勉強できます。
講義解説を読みながら、順番に問題を解き進めることで、基礎から化学の学力を完成していけます。
【科目】
化学(化学基礎+理論化学)
【領域】
pH・電解質・電離・イオン積$K_w$の計算
【単元】
【カリキュラム】
公立高校化学+大学受験化学
【教材プリントダウンロード】
【対象生徒】
化学初心者・公立高校・中高一貫校・大学受験生
【対応試験】
大学入学共通テスト(旧センター試験)
難関国立大学(東大・京大・旧帝大)
難関私立大学(慶応・早稲田・MARCH)
【プロ家庭教師 化学対策講座】
難関大学の化学対策講座カリキュラムをプロ家庭教師に指導依頼できます。

質問と回答